
- Autor Daisy Haig haig@petsoundness.com.
- Public 2023-12-17 03:07.
- Última modificación 2025-01-24 12:35.
Compañía: Stokes Healthcare Inc.
Nombre de la marca: Pilocarpine 0.1% Ophthalmic Solution
Fecha de retiro del mercado: 2019-03-13
Producto: Solución oftálmica de pilocarpina al 0,1%
Número de lote: R180052
Fecha de vencimiento: 17 de febrero de 2019
El producto se utiliza para tratar la presión intraocular alta y se presenta en goteros de 10 mililitros. Se distribuyó en Alabama, California, Colorado, Connecticut, Delware, Florida, Georgia, Iowa, Idaho, Illinois, Kansas, Kentucky, Luisiana, Massachusetts, Maryland, Michigan, Carolina del Norte, Nueva Jersey, Pensilvania, Virginia y Washington.
Razón de la retirada:
Stokes Healthcare Inc. está retirando voluntariamente 1 lote de 81 unidades de solución oftálmica de pilocarpina al 0,1%, al nivel del consumidor y del consultorio veterinario. Se ha encontrado que la solución oftálmica contiene un nivel más alto del conservante cloruro de benzalconio que el típico.
Declaración de riesgo: El uso de este producto podría provocar un síndrome de ojo seco irreversible debido a la concentración elevada de conservante en estas gotas para los ojos. El ojo seco requiere una intervención médica de por vida y puede provocar dolor y ceguera si no se trata. Si su mascota muestra un parpadeo excesivo, hinchazón del ojo, secreción ocular u otros signos de irritación ocular, comuníquese con su veterinario. Stokes Healthcare ha realizado una extensa investigación sobre este evento. Hasta la fecha, Stokes Healthcare Inc. ha recibido 8 quejas de irritación ocular, un efecto secundario común de la solución oftálmica de pilocarpina.
Qué hacer:
Stokes Healthcare Inc. está notificando a sus clientes por carta y por teléfono y está haciendo arreglos para la devolución y reemplazo de todos los productos retirados del mercado. Los consumidores y los consultorios veterinarios que tengan la solución oftálmica de pilocarpina al 0.1% que se retira del mercado deben dejar de usar el producto de inmediato y comunicarse con Stokes Healthcare Inc. para coordinar la devolución y el reemplazo.
Los consumidores que tengan preguntas sobre este retiro pueden comunicarse con Stokes Healthcare Inc. llame al (856) 454-3368 o envíe un correo electrónico a RHamara@StokesHealthcare.com Lunes a viernes de 9 a. M. A 7 p. M. Y sábados de 9 a. M. A 1 p. M. Hora estándar del Este. Los consumidores deben comunicarse con el veterinario de su mascota si su mascota ha experimentado algún problema que pueda estar relacionado con la toma o el uso de este medicamento.
El Centro de Medicina Veterinaria recomienda llamar a la compañía farmacéutica para informar sobre experiencias adversas con medicamentos o defectos del producto para productos animales aprobados por la FDA. La compañía farmacéutica responsable del producto aprobado debe enviar estos informes a la FDA. Llame al (856) 454-3316.
- Si prefiere informar directamente a la FDA, puede enviar el Formulario FDA 1932a siguiendo el enlace al formulario que se encuentra en https://www.fda.gov/AnimalVeterinary/SafetyHealth/ReportaProblem/ucm055305.htm y siguiendo las instrucciones para enviar por correo electrónico el formulario completo a la FDA.
- Si tiene alguna pregunta sobre los informes de ADE o necesita una copia impresa del formulario, comuníquese con CVM por correo electrónico a AskCVM@fda.hhs.gov o por teléfono al 1-888-FDA-VETS (1-888-332-8387).
Fuente: FDA
Recomendado:
Columbia River Natural Pet Foods Inc. Expande Voluntariamente El Retiro Del Mercado Para Incluir Pastel De Vaca Y Carnes Frescas Congeladas De Pollo Y Verduras Para Perros Y Gatos
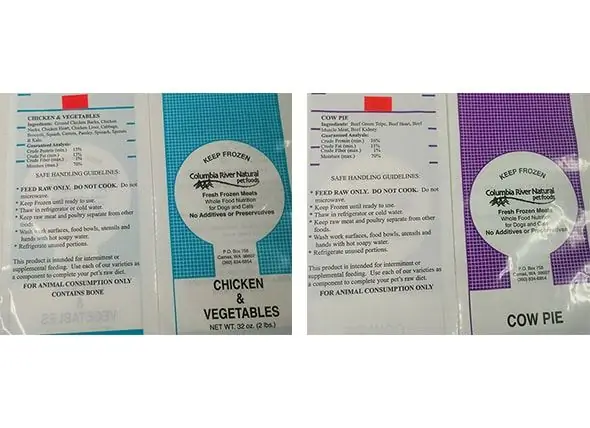
Compañía: Columbia River Natural Pet Foods Inc. Fecha de retiro del mercado: 24/12/2018 Ambos productos se distribuyeron en Alaska, Oregon y Washington a través de tiendas minoristas y entrega directa. Producto: Carne fresca congelada de pastel de vaca para perros y gatos, 2 libras (261 paquetes) Viene en bolsas de plástico moradas y blancas. N
Columbia River Natural Pet Foods Inc. Emite El Retiro Del Mercado De Carnes Frescas Congeladas De Pastel De Vaca Para Perros Y Gatos Debido A Un Posible Riesgo Para La Salud De Lis

Compañía: Columbia River Natural Pet Foods Inc. Fecha de retiro del mercado: 12/05/2018 Distribuido en Alaska, Oregon y Washington a través de tiendas minoristas y entrega directa. Producto: Carne fresca congelada de pastel de vaca para perros y gatos, 2 libras Viene en bolsas de plástico moradas y blancas. N
ANF Pet Inc. Emite El Retiro Preventivo Voluntario Del Alimento Seco Para Perros Debido A Los Niveles Potencialmente Elevados De Vitamina D

Compañía: ANF, Inc. Fecha de retiro del mercado: 28/11/2018 Producto: ANF Alimento seco para perros con cordero y arroz, 3 kg (UPC: 9097231622) Código de caducidad: 23 de noviembre de 2019 Distribuido a tiendas minoristas en Puerto Rico
Nutrisca Emite El Retiro Del Mercado De Alimentos Secos Para Perros Y Productos Para Mascotas Natural Life Alimentos Secos Para Perros Debido A Niveles Elevados De Vitamina D

Nutrisca emite el retiro del mercado de alimentos secos para perros y productos para mascotas Natural Life Alimentos secos para perros debido a niveles elevados de vitamina D Compañía: Nutrisca Nombre de la marca: Nutrisca and Natural Life Pet Products Fecha de retiro del mercado: 11/2/2018 Alimento seco para perros Nutrisca Producto: Alimento seco para perros Nutrisca con pollo y garbanzos, 4 libras (UPC: 8-84244-12495-7) Código de fecha de caducidad: 2/25 / 202
Silver Star Brands, Inc. Emite El Retiro Voluntario A Nivel Nacional De Medicamentos Para Humanos Y Animales Debido A La Contaminación Microbiana

Silver Stars Brands, Inc. emite el retiro voluntario a nivel nacional de productos farmacéuticos de origen animal y humano debido a la contaminación microbiana Compañía: Silver Star Brands, Inc. Nombre de la marca: PetAlive Fecha de retiro del mercado: 10/03/2018 Spray oral PetAlive Plump-Up Pet (UPC: 818837013908) Número de lote: K011617E Fecha de caducidad : 01/20 Spray oral PetAlive Allergy Itch Ease (UPC: 818837011102) Número de lote: K111617B Fecha de cadu
